Nature Genetics | 中南大学首次揭示琥珀酰化修饰调控PD-L1与肿瘤免疫的新机制
发布时间:2025-05-14 15:33分类: 无 浏览:335评论:0

在肿瘤免疫治疗领域,免疫检查点抑制剂(如抗PD-1和抗PD-L1单克隆抗体)的问世是一个重大的进步。然而,这类疗法的有效率仍然有限,仅15%~25%的患者显示出显著疗效。更为棘手的是,约三分之一起初有响应的患者后续仍会遭遇疾病复发问题。由此,寻找可靠的预测性生物标志物和深入解析肿瘤耐药机制显得尤为迫切。
目前,研究多聚焦于PD-L1的转录调控,但关于其蛋白稳定性调节的动态机制仍未明朗。事实上,线粒体代谢不仅参与能量生产,还通过蛋白翻译后修饰(如乙酰化、丙二酰化和琥珀酰化)来调节蛋白质功能。

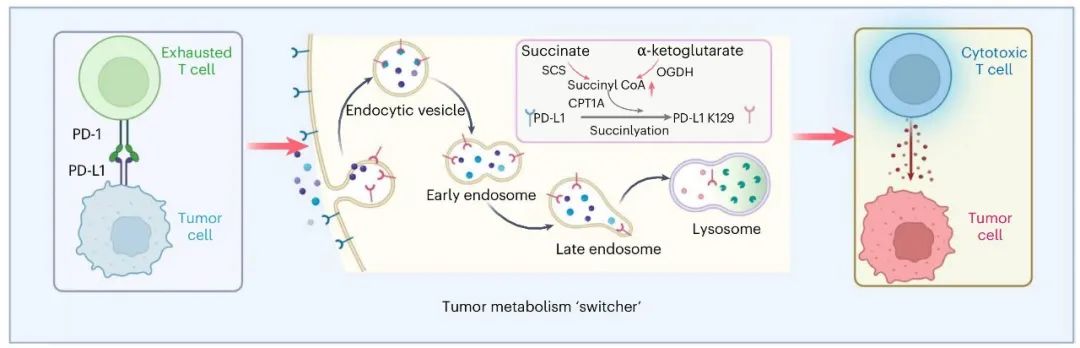
线粒体代谢产物调控抗肿瘤免疫
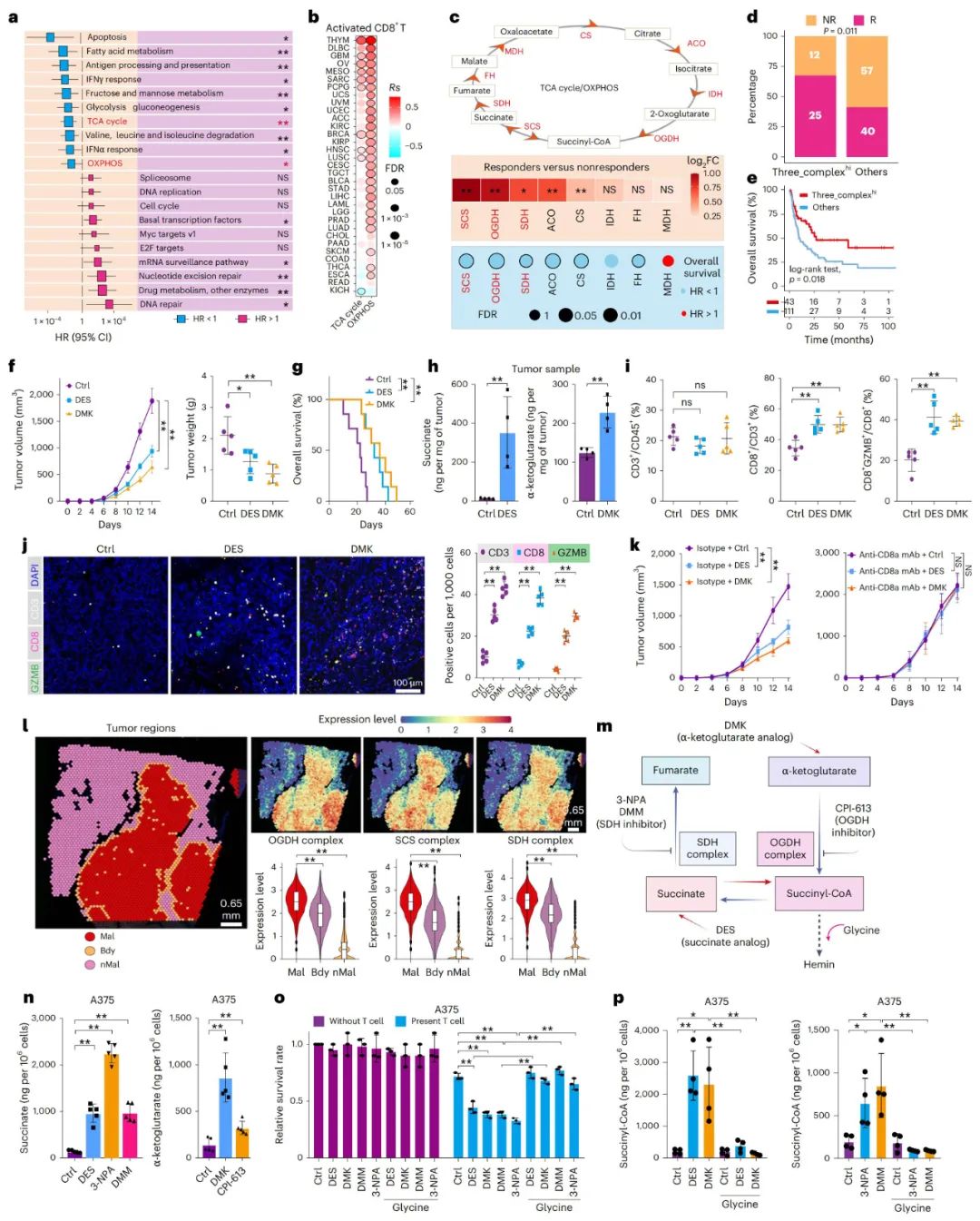
琥珀酰辅酶A调控PD-L1降解激活T细胞
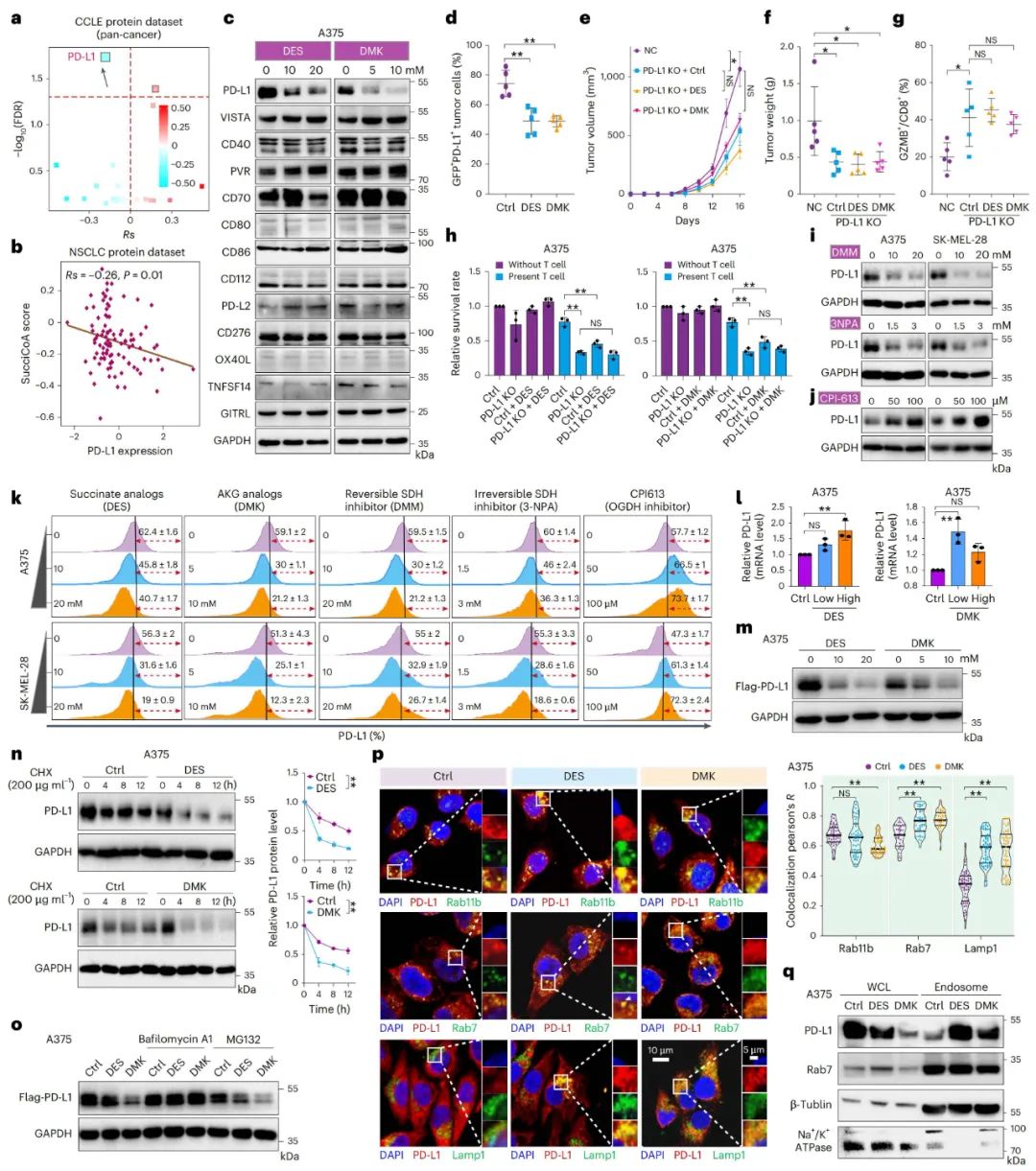
PD-L1第129位赖氨酸的琥珀酰化促使其降解
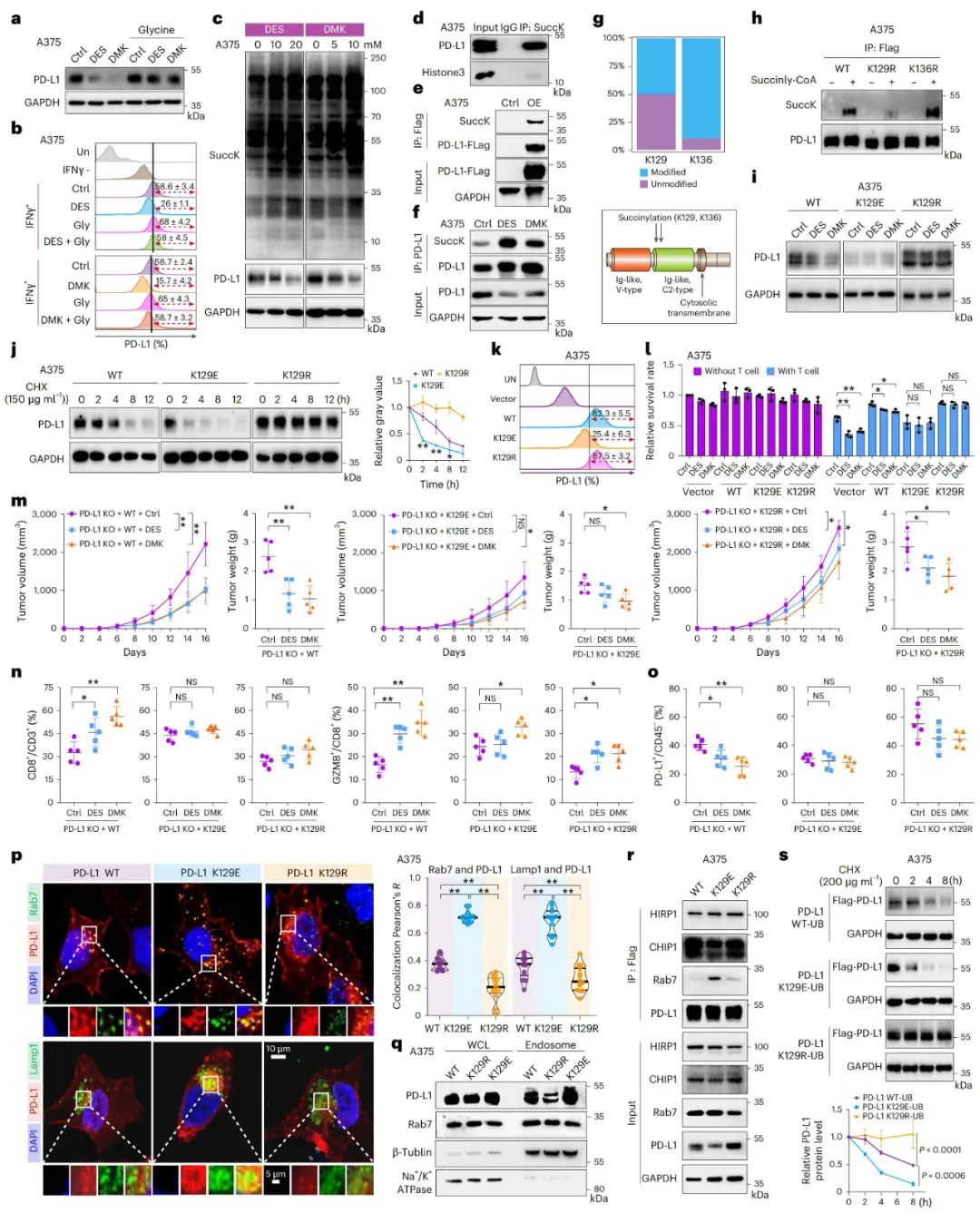
CPT1A介导PD-L1的琥珀酰化修饰
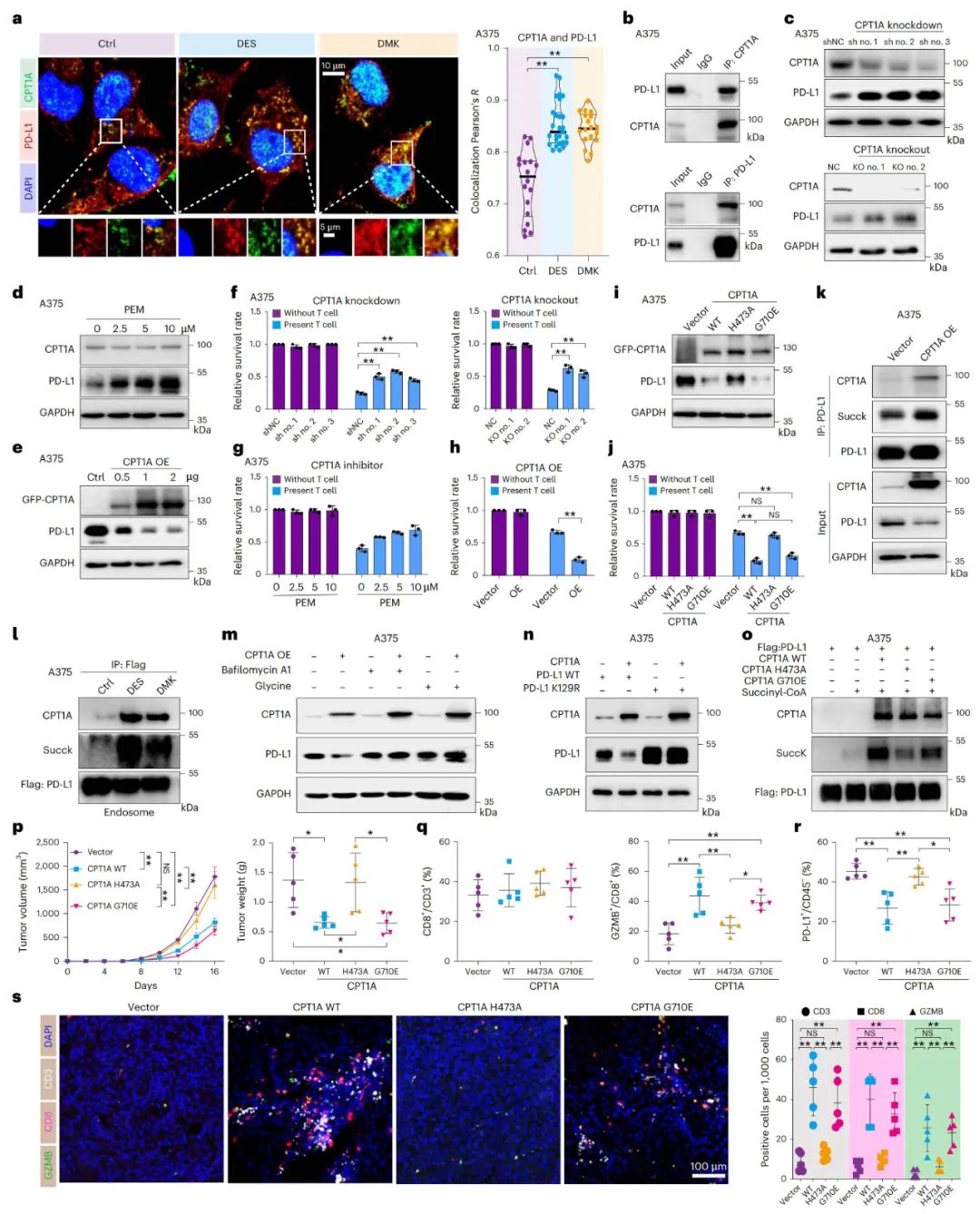
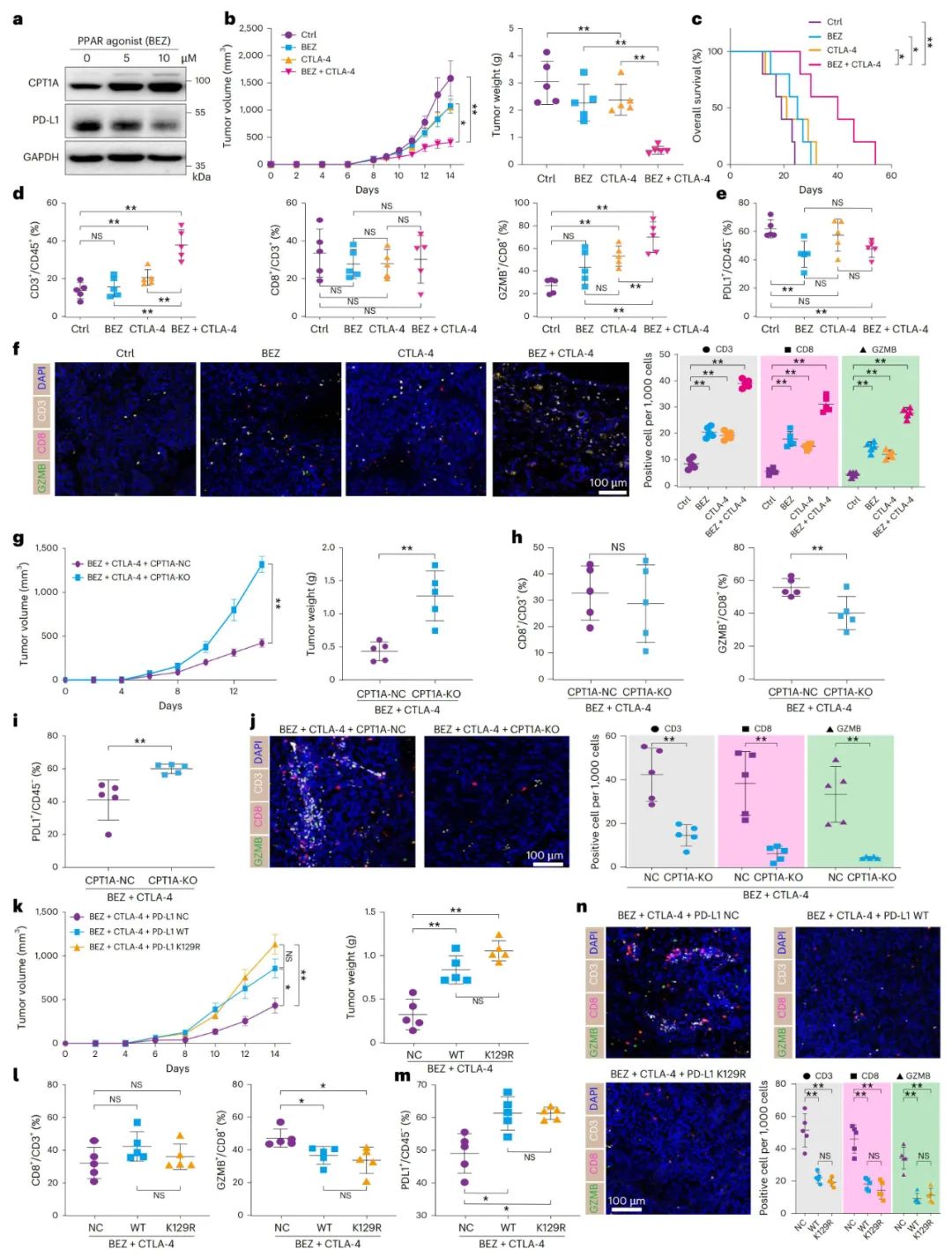
CPT1A水平上调与CTLA-4阻断疗法的协同增效
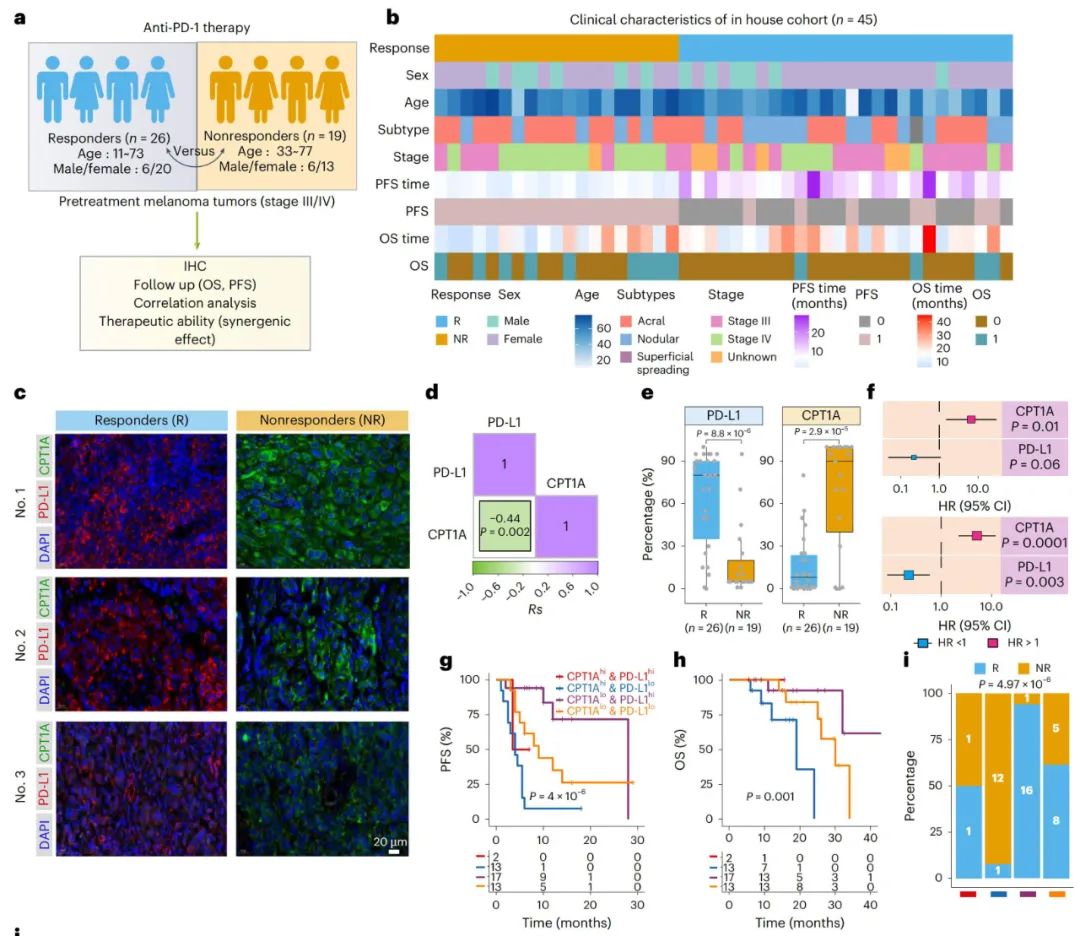
CPT1A水平与黑色素瘤中PD-1单抗疗效的相关性
VectorBuilder云舟生物是世界知名分子生物学家蓝田博士创办的基因递送领军企业,在全球设有10余家子公司和办事处,2023年晋升为全球独角兽企业。
云舟生物独创“载体家”平台,开启了个性化基因载体的商品化时代;目前已赋能全球90多个国家和地区,为超过4500家顶尖科研院校和制药公司提供服务,在QS前100高校的客户覆盖率达到了90%,全球TOP30药企的客户覆盖率亦超过90%,产品成果的全球文献引用量逾5000篇。
云舟生物的基因药物CRO、CDMO项目遍布北美、欧洲、日本等多个国家和地区,已成功助力全球数十个项目成功开展IIT或IND研究,其中GMP级别的质粒和慢病毒载体已获得美国FDA的IND正式批准,用于在美国的多中心临床试验。
云舟生物致力于系统性攻克基因递送行业的关键技术瓶颈,为行业和世界创造不可取代的价值。






相关文章
- 九坤市场周报(10.28-11.01)|Market Review
- “金融为民谱新篇 守护权益防风险” —— 瑞众保险2024年“金融教育宣传月活动”盛大启幕
- 让园林更懂生活,解密融创产品力背后的匠心细节
- 2025首场外卖商家恳谈会,大家提了这些建议
- 11月比格福利日,记者/消防员39.99元吃自助
- 中通快递四川德阳广汉网点:从深度亏损到常态盈利,他们靠什么打了一场漂亮的翻身仗?
- 和利时祝您新春快乐,蛇年大吉,巳巳如意
- CeMAT ASIA 2024丨中科创达旗下晓悟智能携多款智能机器人新品亮相 为智能化转型升级贡献力量!
- 打造 “健康中国” 示范样板 推动“体育+健康”产业融合 伊利集团与华舰体育集团达成战略合作
- 祝贺! 天路一号卫星发射成功
- 排行
-
- 12025科技特长生招生正式开启!一文了解科技特长生政策趋势,开启升学快通道→
- 2携手华为,共创金融新纪元 —— 赢时胜亮相2024华为全联接大会,共绘金融科技生态蓝图
- 3跨境百科 | 2025 TEMU春夏女装新品重点揭晓!
- 4理论深度分析Autosar CAN 时间同步
- 5GPA低到“蕉绿”?大一到大四处处都是补救翻盘机会!
- 6联咏科技:引领显示驱动芯片创新,布局未来显示技术版图
- 7工薪家庭无负担!免学费!低成本留学就去这三个国家!
- 8China-Serbia Youth International Cultural Exchange Program Ends!
- 9满心热爱,奔赴星辰!英华2024-2025学年开学典礼圆满举行

