一文get | 抗体药工艺与质量关键挑战:HCP残留检测的「破局之道」
发布时间:2025-08-01 14:54分类: 无 浏览:102评论:0
近日,由佰傲谷主办的QbD 2025第六届生物药质量科学大会于在北京圆满落幕,奕安济世荣幸受邀参加,分析科学部门副总监孙强祖博士于会上分享了题为《生物药中HCP残留检测方法选择的难点与挑战》的专题演讲,从药企角度深入探讨了HCP(宿主细胞蛋白)残留检测的关键技术、监管要求及行业实践。以下是本次演讲的核心内容总结,助力行业伙伴更好地理解HCP质量控制的前沿进展。
HCP残留:不可忽视的「隐形风险」
安全性与稳定性威胁
HCP是生物药生产过程中不可避免的杂质,高风险HCP可能带来以下风险:
产品稳定性:部分HCP具有蛋白酶、吐温酶活性,可能导致药物降解或药效变化。
免疫原性:诱发人体不良免疫反应(如过敏、抗药抗体产生)。
生物活性干扰:如糖基化酶类HCP可能影响药物糖型结构。
全球监管趋严
中国药典、USP<1132>、欧洲药典均将HCP列为关键质量属性(CQA),要求放行检测灵敏度达ng/mg级,需贯穿药物全生命周期。
USP<1132>中详细介绍了HCP放行与表征检测方法的要点:建议临床后期阶段采用专属HCP检测方法,并应进行充分表征。
检测方法选择:从研发到上市的「动态策略」
主流检测技术
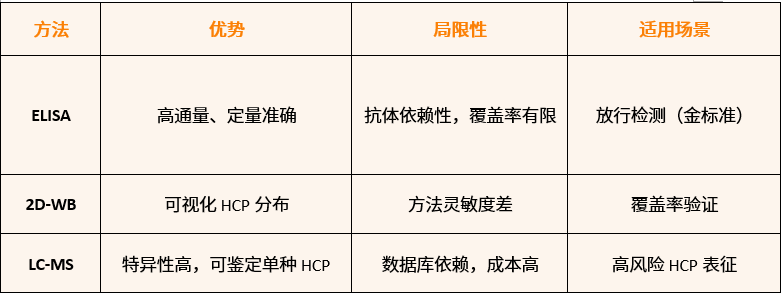
项目阶段适配建议
▶ 早期研发阶段
基于timeline和成本考虑,推荐商业化ELISA试剂盒。
▶ 关键临床/上市阶段
中美申报的监管要求不同:
· 可使用商业化试剂盒或变更为项目/平台工艺专属试剂盒;
·应选择合适的覆盖率研究方法;
·高风险HCP的风险监控(如PLBL2、组织蛋白酶等)。
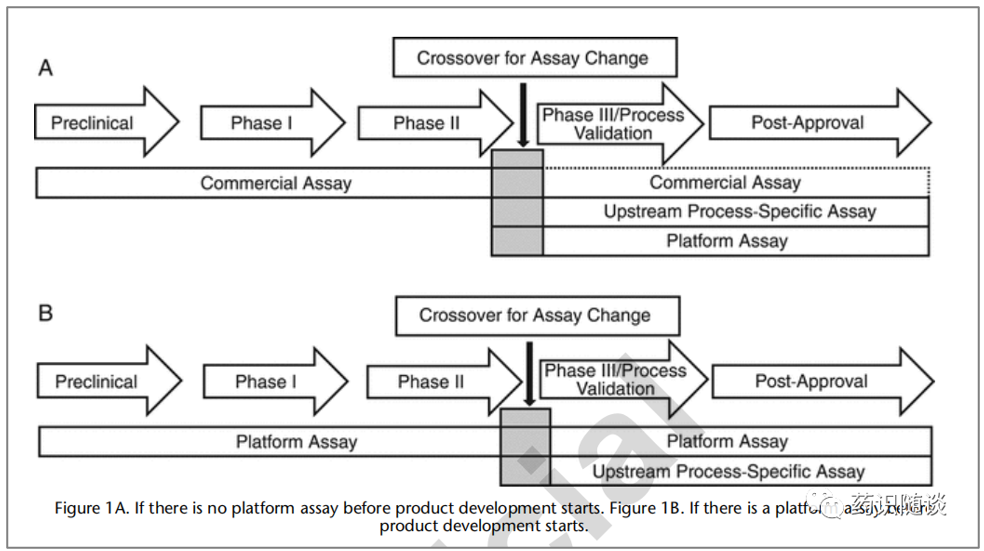
USP<1132>中对不同临床阶段的HCP检测方法的建议
工艺变更的「连锁反应」与应对

奕安济世「全周期」HCP管控方案

结语

HCP残留管控是生物药质量控制的「必答题」。奕安济世凭借成熟的CMC团队与一体化平台,为合作伙伴提供从方法开发到工艺验证的全流程解决方案。
推荐阅读
关于奕安济世
About HJB
奕安济世具有丰富的细胞系开发、工艺开发、临床样品生产及放行、IND/BLA申报的全流程经验。奕安济世在杭州拥有工艺开发中心及符合cGMP标准的原液及成品生产车间,通过技术的不断创新及稳定的连续化生产工艺,可极大缩短工艺开发进程和降低生产成本,为生物药创新合作伙伴提供优质、可靠、快速的CDMO服务。
我们与客户共赢,我们与时代共进。
业务咨询:
CDMO@hjbbio.com | 13601691087 | 0571-2827 9502*8555




